酯化反應,是一類有機化學反應,是醇跟羧酸或含氧生成和水的反應。分為羧酸跟醇反應和無機含氧酸跟醇反應和無機強酸跟醇的反應三類。跟醇的酯化反應是可逆的,並且一般反應極緩慢,故常用濃硫酸作催化劑。多元羧酸跟醇反應,則可生成多種酯。無機強酸跟醇的反應,其速度一般較快。典型的酯化反應有乙醇和醋酸的反應,生成具有芳香氣味的乙酸乙酯,是製造染料和醫藥的原料。酯化反應廣泛的套用於有機合成等領域。
基本介紹
- 中文名:酯化反應
- 外文名:esterification
- 類別:化學反應
- 適用範圍:化學學科
- 作用:有機物合成
- 反應速度:反應極緩慢
基本含義,反應特點,反應機理,反應類型,典型套用,
基本含義
兩種化合物形成(典型反應為酸與醇反應形成酯),這種反應叫酯化反應。
分兩種情況:跟醇反應和無機含氧酸跟醇反應。
羧酸跟醇的反應過程一般是:羧酸分子中的羥基與醇分子中羥基的氫原子結合成水,其餘部分互相結合成酯。這是曾用示蹤原子證實過的。口訣:酸脫羥基醇脫氫(酸脫氫氧醇脫氫)。羧酸跟的酯化反應是可逆的,並且一般反應極緩慢,故常用濃硫酸作催化劑。多元羧酸跟醇反應,則可生成多種酯。
舉例如下:
1)乙酸和乙醇在濃硫酸加熱的條件下反應生成乙酸和水
ch3cooh c2h5oh<------>ch3cooc2h5 h2o
2)乙二酸跟甲醇可生乙二酸氫甲酯或乙二酸二甲酯
hooc—cooh ch3oh<------>hooc—cooch3 h2o
3)無機強酸跟醇的反應,其速度一般較快,如濃硫酸跟乙醇在常溫下即能反應生成硫酸氫乙酯。
c2h5oh hoso2oh<------>c2h5oso2oh h2o
4)硫酸氫乙酯
c2h5oh c2h5oso2oh→(可逆符號)(c2h5o)2so2 h2o
多元醇跟無機含氧強酸反應,也生成酯。
一般來說,除了酸和醇直接發生酯化反應生成酯外,能反應(但不一定是酯化反應)生成酯的還有以下三類物質:和醇、、發生反應;酸酐和醇、酚、醇鈉發生反應;烯和醇、酚、醇鈉發生反應;
反應特點
屬於,一般情況下反應進行不徹底,依照反應平衡原理,要提高酯的產量,需要用從產物分離出一種成分或使反應物其中一種成分過量的方法使反應正方向進行。酯化反應屬於單行雙向反應。
屬於。
反應機理
sn2機理
在酯化反應中,存在著一系列可逆的平衡反應步驟。步驟②是酯化反應的控制步驟,而步驟④是酯水解的控制步驟。這一反應是sn2反應,經過加成-消除過程。
酯的氧來自羥基,水的氧來自羧基
採用同位素標記醇的辦法證實了酯化反應中所生成的水是來自於羧酸的羥基和醇的氫。但羧酸與叔醇的酯化則是醇發生了烷氧鍵斷裂,中間有碳正離子生成。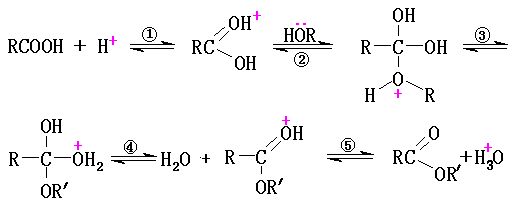 圖二 sn2原理反應式
圖二 sn2原理反應式
 圖二 sn2原理反應式
圖二 sn2原理反應式判定酯化反應中生成的水中氧原子來自羧基的另一個判據是有光活性的醇形成的酯仍然有光活性,因為若氧來自羥基,則羧基的氧進攻醇的不對稱碳時,會引起消旋,即生成的酯會外消旋失去光活性。
在酯化反應中,醇作為親核試劑對羧基的羰基進行親核攻擊,在質子酸存在時,羰基碳更為缺電子而有利於醇與它發生親核加成。如果沒有酸的存在,酸與醇的酯化反應很難進行。
對於反應活性:甲酸>直鏈羧酸>側鏈羧酸>芳香酸;
甲醇>伯醇>仲醇>叔醇>酚(以上機理進適用之仲醇,即2℃醇)。
特別說明
- 當叔醇酯化時,三級醇位阻過大,上圖(圖二)中第二步反應的難以進行,需要用硫酸將醇轉化為碳正離子(carboncation),羧基中與碳單鍵連結的氧會變為酯基中碳氧雙鍵的氧,原雙鍵氧進攻碳正離子與原醇部分連線(此機理由同位素示蹤法證明)——由於碳正離子容易與水結合變回醇,此反應產率極低;
- 位阻大的羧酸同樣難以與醇直接結合,此時需要醯基正離子機理,即羧基的-oh被濃質子溶劑(如純的硫酸)脫掉,再與醇混合進行酯化,此種機理產率較高;
- 酚的酯化一般使用醯鹵進行,一般不在酯化反應里討論,有興趣的朋友可以參見邢其毅《有機化學基礎(第三版)》下冊中章節14.2醯滷的內容。
反應類型
費歇爾酯化
酯化反應一般是。傳統的酯化技術是用酸和醇在酸(常為)催化下加熱反應。這個反應也稱作費歇爾酯化反應。濃硫酸的作用是催化劑和吸水劑,它可以將羧酸的,增強羰基碳的,使加快;也可以除去反應的副產物水,提高酯的。
如果原料為低級的羧酸和醇,可溶於,反應後可以向反應液加入水(必要時加入飽和溶液),並將反應液置於中作分液處理,收集難溶於水的上層酯層,從而純化反應生成的酯。碳酸鈉的作用是與羧酸反應生成,增大羧酸的溶解度,並減少酯的溶解度。如果產物酯的沸點較低,也可以在反應中不斷將酯蒸出,使反應平衡右移,並冷凝收集揮發的酯。
但也有少數酯化反應中,酸或醇的羥基質子化,水離去,生成正離子或中間體,該中間體再與醇或酸反應生成酯。這些反應不遵循“酸出羥基醇出氫”的規則。
經過再與醇反應生成酯。醯氯的反應性比羧酸更強,因此這種方法是製取酯的常用方法,產率一般比直接酯化要高。對於反應性較弱的和醇,可加入少量的,如氫氧化鈉或。 h3c-cocl ho-ch2-ch3 → h3c-coo-ch2-ch3 h-cl 羧酸經過再與醇反應生成酯。 羧酸經過再與反應生成酯。反應機理是羧酸根負離子對鹵代烴α-碳的。
氯化亞碸作用下酯化
基本方法是將酸溶於過量低級醇(一般是甲醇或乙醇)中,然後低溫下滴加氯化亞碸,該方法條件溫和,操作方便,反應時間短,產率高,特別適用於胺基酸的酯化,且由於該反應低級醇過量,一般不影響酸中的醇羥基。
此外,氯化亞碸與dmf組成的vilsmeier-haack型複合物可以用於具位阻醇的酯化。kaul等採用該試劑活化羧基使各種伯醇包括具有位阻的醇和多元醇進行酯化,收率近定量。
steglich酯化反應
羧酸與醇在和少量的存在下酯化。這種方法尤其適用於三級醇的酯化反應。dcc是反應中的失水劑,dmap則是常用的酯化反應催化劑。
山口酯化
2,4,6-三氯苯甲醯氯與羧酸底物作用生成混酐使羧酸活化,繼而與醇順利作用成酯。dmap為酯化的催化劑。
典型套用
乙醇和乙酸(俗名醋酸)進行酯化生成具有芳香氣味的,是製造染料和醫藥的原料。在某些菜餚烹調過程中,如果同時加醋和酒,也會進行部分酯化反應,生成芳香酯,使菜餚的味道更鮮美。如果要使反應達到工業要求,需要以硫酸作為催化劑,硫酸同時吸收反應過程生成的,以使酯化反應更徹底。
甲醇和進行酯化反應,會生成,而對苯二甲酸二甲酯與發生,可以生成,即、辛醇和對苯二甲酸可以合成增塑劑對苯二甲酸二辛酯。
醇類和也能進行酯化反應,例如甲醇和硫酸反應生成,是一種甲基化試劑,可以為碳水化合物引入甲基。

